|
|
2017-11-06 09:00 Синтетическая биология: от наблюдения к вмешательствуНа протяжении всего существования человечества основным способом узнать что-либо было наблюдение. Аристотель разбивал куриные яйца на разных стадиях инкубации и зарисовывал увиденное, в дальнейшем пытаясь это объяснить. С течением времени появился чуть более достоверный метод — эксперимент, в котором мы полностью управляем условиями наблюдения. Однако в последнее время ученым все больше хочется вмешаться в живые процессы, придумать новые полезные человечеству гены, или же просто что-нибудь там сломать и посмотреть, что будет. В современной биологии вопросами вмешательства в живые системы занимаются синтетические биологи и биоинженеры. Они разрабатывают рациональные подходы к управлению и программированию клеточных функций; изучают методы создания искусственных генетических конструкций, схем и сетей. Можно как искать вдохновение в природе, перемещая гены между организмами, так и придумывать совершенно новые, не имеющие аналогов в живом мире системы. Для лучшего понимания материала быстро освежим школьные знания. Для того чтобы дать подробный обзор современных достижений синтетической биологии, потребовалась бы целая серия статей, так что я ограничусь несколькими избранными, наиболее полезными для человека, или же просто самыми захватывающими разработками. Начнем с простого — с поломки Направленный мутагенез открывает сравнительно простой способ определить роль конкретного гена/белка в клеточных процессах — тот процесс, что перестал работать вследствие поломки этого гена или белка, очевидным образом зависит от их функции. Например, выключаем некий интересный нам ген у растения ? вместо нормальных цветков видим только тычинки и пестики ? вывод: ген участвует в формировании частей цветка. Казалось бы, в природе и так полно мутантов, зачем же создавать новых? Но найти, какой ген выключился у природного мутанта, гораздо сложнее, чем вручную сломать определенный нами же ген. Чужие гены Вместо того чтобы заниматься выключением генов, можно попробовать внести в организм гены из других видов. Классические исследования в области генной модификации направлены на сельское хозяйство и скотоводство [1–3], но это не значит, что мы не можем решать и более интересные проблемы теми же методами. 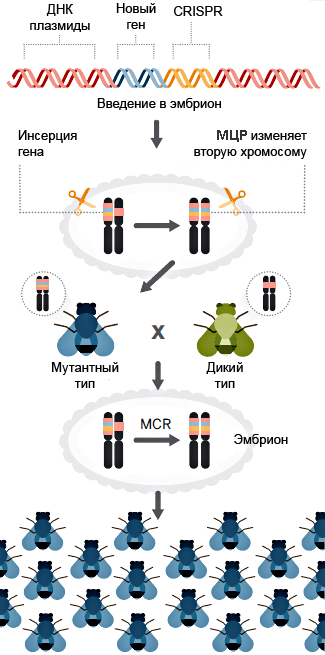 Рисунок 2. Мутагенная цепная реакция на примере дрозофилы. Ферменты рекомбиназы в зиготе переводят мутацию в гомозиготный характер за счет изменения второй гомологичной хромосомы. [11], рисунок адаптирован Тропические заболевания в последнее время привлекают все больше медийного внимания. Это и вирус Зика [4], [5], и лихорадка Денге, и малярия. И именно последняя инфекция вызывает больше всего опасений. В прошлом веке малярийный плазмодий стал устойчивым почти ко всем классическим препаратам [6]. Артемизинин, разработанный в 1970-е годы (за его разработку, кстати, вручили Нобелевскую премию 2015 года [7]), стал новой надеждой врачей и действительно привел к резкому снижению смертности от малярии за последние десятилетия. Сейчас артемизинин коммерчески производят [8] с использованием искусственного биохимического пути — ферменты, проводящие нужные реакции, собрали из разных бактерий в один модифицированный штамм. C точки зрения химиков-технологов это замечательное решение — мы не заботимся о выделении промежуточных продуктов, тратим меньше энергии на проведение реакций, да и выделить продукт легко — всего лишь отфильтровать бактерий. Для решения проблемы заболеваний, переносимых насекомыми, есть другое решение — мутагенная цепная реакция [9], [10]. Название звучит страшновато, и это во многом соответствует действительности. Суть метода — сделать изменение в геноме распространяющимся в популяции, с потенциальной возможностью изменить в итоге абсолютно все организмы данного вида. На рисунке 2 показано, как мутантный тип (обозначен синим цветом) может стать доминирующим в популяции [11]. Мы нарушаем менделевские законы наследования с помощью внесения в геном модифицирующих его же ферментов. С помощью мутагенной цепной реакции можно сделать комаров неспособными переносить малярию [12], причем все потомки модифицированного комара также будут не способны заражать людей. У многих ученых мутагенная цепная реакция вызывает большие опасения. Мутация, однажды введенная в геном единственной особи, неконтролируемо распространяется в геномах детей, внуков, правнуков и всех последующих поколений популяции. Из-за этого «дикие» организмы могут исчезнуть с лица земли. Менее радикальный, но очень похожий метод применяют уже сейчас. В Бразилии фабрики производят ГМ-комаров, потомство которых стерильно, и выпускают их в природу. Это помогает снизить количество комаров, переносящих Денге, Зика, малярию и тому подобное. Однако так как метод работает всего на двух поколениях, опасности, что что-то выйдет из под контроля, нет . Всё происходит по законам популяционной генетики: модифицированные самцы на равных конкурируют за размножение с природными, поэтому количество жизнеспособных детей в следующем поколении снижается, а значит, снижается и численность. Профит! Brain in technicolor Рестриктазы — те самые ферменты, что редактировали геном комаров и дрозофил, — могут также помочь нам и в задачах нейронаук. Метод Brainbow [13–15] позволил ученым-нейрологам покрасить каждый нейрон мозга (в данном случае крысы) в индивидуальный цвет. И дело тут не только в том, что выглядит это безумно красиво, но также и в том, что структура мозга стала различима еще на один уровень точнее: теперь мы можем проследить взаимосвязи нейронов, находящихся в одном слое коры, найти менее очевидные пути проведения сигналов, чуть-чуть приблизить нас к составлению коннектома — карты всех контактов нейронов в мозге. Работает это так: в геном встраивается несколько флуоресцентных белков разных цветов, и, когда клетка дифференцируется в нейрон, рестриктазы случайным образом выключают некоторые из них. Таким образом, каждый нейрон обладает своим цветом и четко выделяется на фоне остальных (рис. 3). 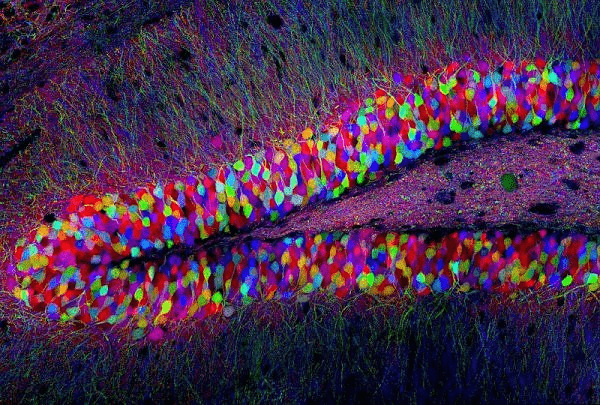 Рисунок 3. Срез гипоталамуса мозга крысы, окрашенный с помощью Brainbow. Сети, схемы, и циклы Но не будем надолго останавливаться на модификациях и вставках одиночных (невзаимодействующих) генов, ведь вся сложность и запутанность живых систем обусловлена, в основном, огромным количеством и многообразием регуляторных систем, действующих как на уровне транскрипции, так и трансляции. Сейчас мы знаем о регуляции достаточно, чтобы пытаться создавать сети генов, работающие как и когда нам нужно. Один из важных типов генных сетей — осцилляторы. Это системы, которые циклически переключаются между несколькими состояниями. К примеру, осцилляторные сети регулируют циркадные ритмы у животных [16], [17], суточные ритмы цианобактерий. Искусственные осцилляторы — одна из первых тем исследований биоинженеров. Бактерии, которые циклически меняют цвет в результате замкнутого круга активаций и выключений разных генов (видео), появились еще в 2008 году [18]. Обладание таким «временным» контролем производства белка может быть очень важно, ведь вся природа живет циклично. При этом более новые статьи говорят о возможности добиться синхронности смены цвета в целой колонии. Видео. Бактерии, которые осциллируют между флуоресцентным и бесцветным состоянием. Другой «цветной» пример — бактерии, которые реагируют на свет, в результате окрашиваясь в тот цвет, которым их освещали [19]. Такое «бактериальное ТВ» (пример на рисунке 4) открывает для нас новый способ контроля за геномом бактерий, который не требует никакого химического воздействия на культуру. Действительно, разные длины волн света, облучающего клетки — нечто вроде кнопок на пульте, включающих синтез разных белков.  Рисунок 4. Ученые из Массачусетского технологического института изобразили логотип своего вуза на чашке Петри с модифицированными бактериями (слева вверху — изображение, которое проецировалось на колонию). РНК Не забыт ученым и другой тип макромолекул — рибонуклеиновые кислоты. Не будем сейчас останавливаться на всей важности РНК для клеток и ее роли в процессах появления жизни [20] и эволюции, а поговорим больше о практической стороне ее использования в синтетической биологии. С одной стороны, РНК гораздо более многолика, чем ДНК и белки: множество конформаций (пространственных структур) позволяет РНК играть любую роль, начиная с носителя генетической информации, рецептора/сенсора, структурного каркаса, заканчивая даже ферментативной активностью. С другой же — РНК максимально неустойчива в чистом виде , не живет в клетке продолжительное время, и работа с ней требует больше времени и сил. Причины этого немного нетривиальны: РНК химически реагирует сама с собой, а еще люди выделяют очень много РНКаз (ферментов, деградирующих РНК) с п?том и дыханием, что играет роль первого барьера защиты от вирусов. 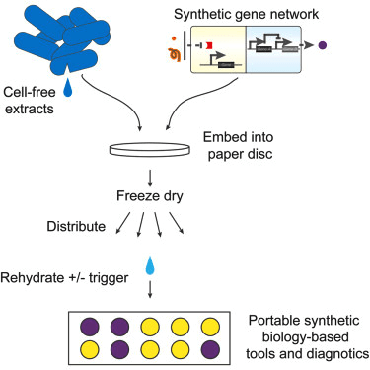 Рисунок 5. Графическое представление разработанных РНК-биосенсоров. Тем не менее, и в этой области есть красивые и сложные разработки. Ученые из Гарвардского университета разработали РНК-биосенсоры [21]: модифицированные клетки нарабатывают распознающие РНК, которые потом в виде клеточного экстракта наносятся на бумагу. Такие тест-полоски высушиваются и могут храниться долгое время. При использовании на них наносят воду и образец, РНК-рецептор узнает некую мишень и запускает синтез цветного белка (рис. 5). Так получаются недорогие, стойкие и точные анализаторы, которые могут с помощью капли слюны или крови идентифицировать болезнь или инфекцию за минуту вне лаборатории в любой точке мира. Биокомпьютер От обзора общих достижений синтетической биологии теперь можно перейти к обещанному рассмотрению темы «биокомпьютеров». Впереди нас ждет самая сложная часть материала, но от этого она не становится менее интересной и красивой. Для начала вспомним, что же делают вычислительные устройства: они принимают некие сигналы на вход, производят их обработку (например, сравнивают, суммируют, выбирают один из нескольких), а затем выдают вывод, соответствующий входным данным. Все живые организмы формально и являются биокомпьютерами: они на основании внешних условий (свет, наличие еды, плотность популяции и многих других) решают, какие синтезировать белки, в каком направлении двигаться, когда размножаться и делать запасы... Но вот только все эти действия — не то, что мы хотим получить. Синтетические биологи хотят сами определять сигналы, процесс «вычислений» и результат. Зачем нам это нужно? Применения «живым вычислениям» можно найти и в биотехнологии, и в медицине, и даже в самой научной деятельности. Они помогут нам добиться значительной автоматизации процессов, будь то анализ крови или мониторинг биотехнологического процесса. И сейчас это во многом реально воплотить в жизнь. Наглядный пример — лактозный оперон, работа которого начинается только при выполнении двух условий: ЕСТЬ лактоза И НЕТ глюкозы. Работа оперона — вывод; глюкоза, лактоза — вводы, условия — обработка. Логика Важный элемент в вычислениях — это логические элементы (так называемые вентили), выполняющие базовые операции, такие как И, ИЛИ, НЕ, и так далее. Они позволяют уменьшить количество сигналов, дают возможность добавить ветвление (если... то... и т.д.) в будущую программу. Такие схемы могут быть реализованы как на уровне генов (рис. 6), так и на стадии трансляции с использованием коротких синтезированных молекул РНК [22–24]. Цепочки белков-активаторов и репрессоров вполне могут считаться транзисторами. 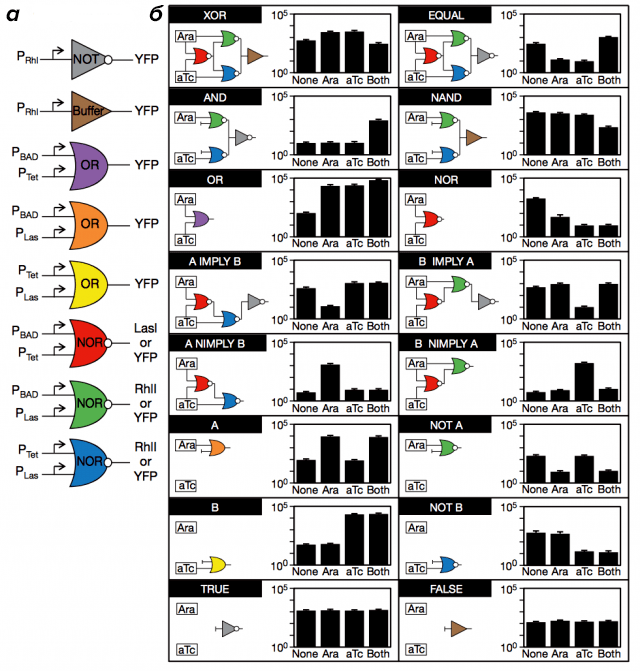 Рисунок 6. Основные логические элементы (а) со схемами их реализации на уровне генов (б). Память Компьютер немыслим без памяти, и биологи понимают это. Первая статья, посвященная искусственной биологической памяти, была опубликована еще в 2000 году [25]. Используя внешний сигнал, ученые смогли переключать клетку между двумя стабильными состояниями (к примеру, между синтезами двух разных белков), формально являющимися единичным битом памяти (рис. 7). 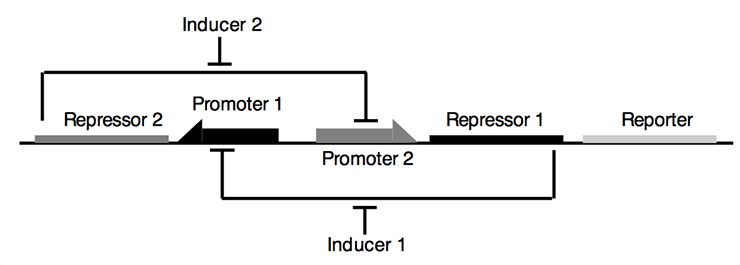 Рисунок 7. Схема генного переключателя. Индукторы 1 и 2 — управляющие сигналы, гены-репрессоры обеспечивают одновременную работу только одной половины (одного из двух состояний) системы. Такие базовые элементы открывают огромный простор для фантазии — к примеру, существуют схемы, считающие количество событий [26], определяющие границу света и тени [27]... Но все же впереди еще долгий путь исследований, идей и прорывов. iGEM  В это верится с трудом, но у синтетической биологии довольно низкий порог вхождения (естественно только при наличии желания и знаний). Как это возможно? Путь лежит через соревнование iGEM (International Genetically Engineered Machine), основанное Массачусетским технологическим институтом в 2004 году. Сейчас участвовать могут команды до шести человек из школьников и студентов-бакалавров (есть также отдельная секция для всех кто «старше»). iGEM представляет из себя настоящий биохакатон: ведь по духу соревнование очень близко движению биохакинга, набирающему популярность в течение последних 10 лет [28]. Весной команды регистрируются и придумывают идею проекта. За лето им предстоит научить бактерий (как самый стандартный и любимый объект) чему-нибудь новому и необычному. Для этого, естественно, требуются наличие лаборатории, умение нетривиально мыслить, хорошая теоретическая подготовка и правильно поставленные лабораторные навыки. А вот с реактивами и исходными материалами все гораздо интереснее: MIT содержит «реестр стандартных биологических запчастей» — базу простейших компонентов, таких как плазмиды, праймеры, промоторы, терминаторы, белки, белковые домены и многое другое (рис. 8), которые хранятся в формате молекул ДНК. Сейчас там содержится более 20 000 зарегистрированных частей, так что можно найти почти все что угодно, начиная с классических флуоресцентных белков, заканчивая сенсорами тяжелых металлов и знаменитым CRISPR/Cas. После того как оргкомитет одобряет проект зарегистрировавшейся команды, им высылают все необходимые компоненты из реестра. 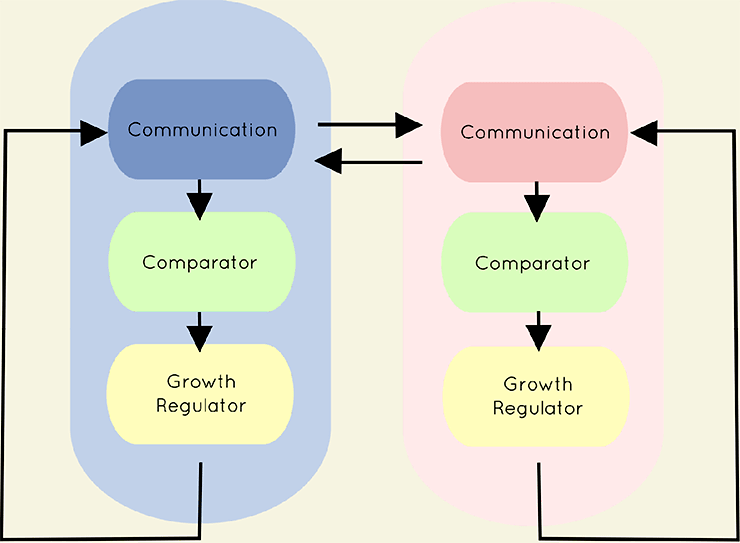 Рисунок 8. Упрощенная схема проекта команды Imperial College London. сайт 2016.igem.org Победителя выбирает коллегия из 120 признанных ученых на ежегодной осенней конференции в Бостоне. Для примера расскажу об одном из проектов студентов Имперского колледжа Лондона (Imperial College London), выигравшем Гранд-приз в 2016 году. Основная идея — регулировать видовое соотношение бактерий в совместных культурах. Это в дальнейшем может позволить по полной реализовать потенциал целых синтетических экосистем. Студенты скомбинировали систему бактериального чувства кворума (с помощью которой бактерии общаются и координируют свое поведение внутри вида), вычислительные схемы из РНК, которые сравнивали кворум-сигналы разных видов, и белки, ингибирующие рост (общая схема показана на рис. 8). Таким образом бактерии всегда в курсе численности всех видов, и за счет ингибиторов роста имеют возможность сохранять ее соотношение постоянным. РНК-компараторы были разработаны с нуля, и также был представлен софт для записи и анализа данных роста совместных культур. Мероприятие это довольно популярно в университетских кругах, количество участников достигает пяти тысяч человек, и даже в России недавно снова появилась своя команда. Итого Казалось бы, это все игрушки, ведь кому сейчас могут понадобиться такие «запрограммированные» бактерии? Они все-таки подвержены мутациям, зашумлению «сигнала» (из-за общей стохастичности внутриклеточных процессов) и довольно медлительны. Но ведь точно так же говорили и об обычных компьютерах в 1940–1950-е годы! Однако сейчас компьютеры используют в областях, немыслимых лет 40 назад. Можно лишь предположить возможные будущие применения биокомпьютеров:
Литература
Источник: biomolecula.ru |
